BALANCEO DE ECUACIONES
INTRODUCCION
En este documento podemos encontrar todo lo relacionado con blanceo de ecuaciones quimicas
OBJETIVOS
El objetivo es darles a entender como funciona todo lo relacioado con el blanceo de cuaciones, sus metodos y paso a paso
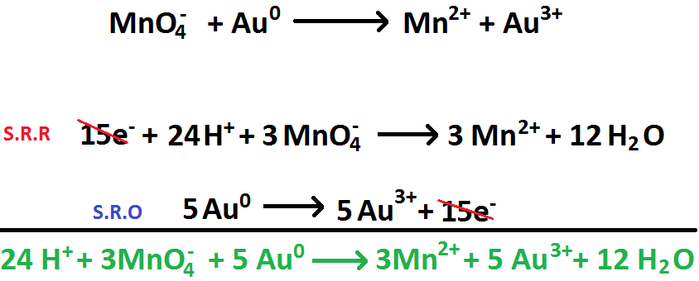

















MARCO TEORICO
BALANCEO DE ECUACIONES QUIMICAS
Balancear una ecuacion quimica es igualar los numeros y clase de astomos, iones o moleculas reactantes con los productos, con la finalidad de cumplir la ley de conservacion de la masa.
Para conseguir esta igualdad se utilizan coeficientes estequiometricos, que son numeros grandes que se colocan delante de los simbolos o formulas para indentificar la cantidad de elementos o compuestos que intervienen en la reaccion quimica. No deben confundirse con los subindices que se colocan e los simbolos o formulas quimicas, ya que estos indican el numero de atomos que conforman la sustancia. Si se modifican lo coeficientes, cambian las cantidades de la sustancia, pero si modifican los subindices, se originan sustancias diferentes.
Para balancear una ecuacion quimica, se debe considerar lo siguiente:
- Conocer las sustancias reaccionantes y productos
- Los subindices indican la cantidad del atomo indicado en la molecula
- Los coeficientes afectan toda la sustancia que preceden
- El hidrogeno y el oxigeno se equilibran al final, porque generalmente foirman agua ( sustancia de relleno ).
Ejemplo:
2 H2SO4
Hay Dos moleculas de acido sulfurico ( o dos moles )
En cada molecula hay dos atomos de hidrogeno, un atomo de azufre y cuatro atomos de oxigeno
PROCEDIMIENTO
- BALANCEO POR TANTEO : Se emplea para balancear ecuaciones sencillas. Se realiza el "calculo" tratando de igualar ambos miembros. Para ello utilizaremos el siguiente Ejemplo:
Identificamos las sustancias que intervienen en la reaccion. En este caso el Nitrogeno y el Hidrogeno para obtener amoniaco.
Se verifica si la ecuacion esta balanceada o no. En este caso notamos que ambis miembros no tienen la misma cantidad de atomos, por lo tanto no esta balanceada
Se balancea la ecuacion colocando coeficientes delante de las formulas o simbolos que los necesitan. Empezar con los elementos metalicos o por el que se encuentra presente en menos sustancias:
Primero balanceamos el nitrogeno: N2 + H2 2 NH3
El hidreogeno y oxigeno quedaran para el final. Seguidamente balanceamos el hidrogeno:
N2 + 3 H2 NH3
Si un coeficiente no es entero, entonces debe multipliucar todos por el mayor de los denominadores. Em este no ocurre.
2. BALANCEO POR OXIDO-REDUCCION ( REDOX ) : Son de intercambio de electrones, las ecuaciones quimicas estaran igualadas cuando el numero de electrones cedidos por el agente reductor sean los mismos que los aceptados por el agente oxidante. El numero de electrones intercambiados se calcula facilmente, teniendo en cuenta la valoracion de los numeros de oxidaccion de los elementos.
Por el numero de oxidaccion: El mecanismo de igualacion es el siguiente:
- Se escribe la ecuacion del proceso y se determina el numero de oxidaccion para cada uno de los elementos participantes en la reaccion, escribiendo este valor en la parte superior del simbolo
- Se establece cuales atomos sufren cambio en su numero de oxidaccion y cuales de ellos es el oxidado y el reducido
- Se calcula el numero de oxidacion de cada uno de estos atomos, tanto enn su forma oxidada como reduccion y se produce a escribir ecuciones ionicas
- Se establecen coeficientes minimas del oxidante y del reductor. De tal forma que el numero total de electrones ganados y perdidos sea el mismo: para ellos multiplicamos en las ecuaciones ionicas el numkero de electrones por factores adecuados
- Se asignan como coeficientes de las sustancias afectadas en la ecuacion, los factores que se utilizaron para el numero de electrenoes sea igual
- Por ultimo, el equilibrio se logra por el metodo de ensayo y error
EJEMPLOS:
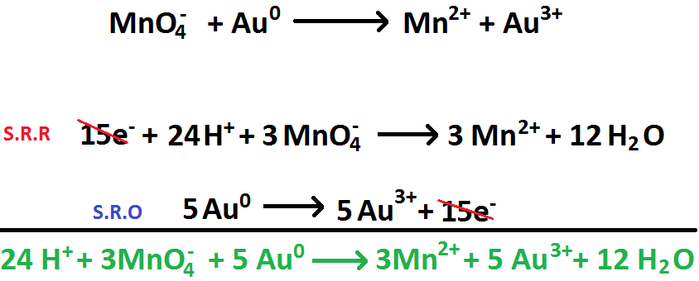
PANTALLAZOS DE LA ACTIVIDAD VIRTUAL
CONCLUSIONES
Con este documento nos podemos dar cuanta que el bloanceo de ecuaciones con cualquiera de las dos es muy facil solo es de concentracion y de practica
WEBGRAFIA
Comentarios
Publicar un comentario